- English
- Chinese
- French
- German
- Portuguese
- Spanish
- Russian
- Japanese
- Korean
- Arabic
- Irish
- Greek
- Turkish
- Italian
- Danish
- Romanian
- Indonesian
- Czech
- Afrikaans
- Swedish
- Polish
- Basque
- Catalan
- Esperanto
- Hindi
- Lao
- Albanian
- Amharic
- Armenian
- Azerbaijani
- Belarusian
- Bengali
- Bosnian
- Bulgarian
- Cebuano
- Chichewa
- Corsican
- Croatian
- Dutch
- Estonian
- Filipino
- Finnish
- Frisian
- Galician
- Georgian
- Gujarati
- Haitian
- Hausa
- Hawaiian
- Hebrew
- Hmong
- Hungarian
- Icelandic
- Igbo
- Javanese
- Kannada
- Kazakh
- Khmer
- Kurdish
- Kyrgyz
- Latin
- Latvian
- Lithuanian
- Luxembou..
- Macedonian
- Malagasy
- Malay
- Malayalam
- Maltese
- Maori
- Marathi
- Mongolian
- Burmese
- Nepali
- Norwegian
- Pashto
- Persian
- Punjabi
- Serbian
- Sesotho
- Sinhala
- Slovenian
- Somali
- Samoan
- Scots Gaelic
- Shona
- Sindhi
- Sundanese
- Swahili
- Tajik
- Tamil
- Telugu
- Thai
- Ukrainian
- Urdu
- Uzbek
- Vietnamese
- Welsh
- Xhosa
- Yiddish
- Yoruba
- Zulu
- Kinyarwanda
- Tatar
- Oriya
- Turkmen
- Uyghur

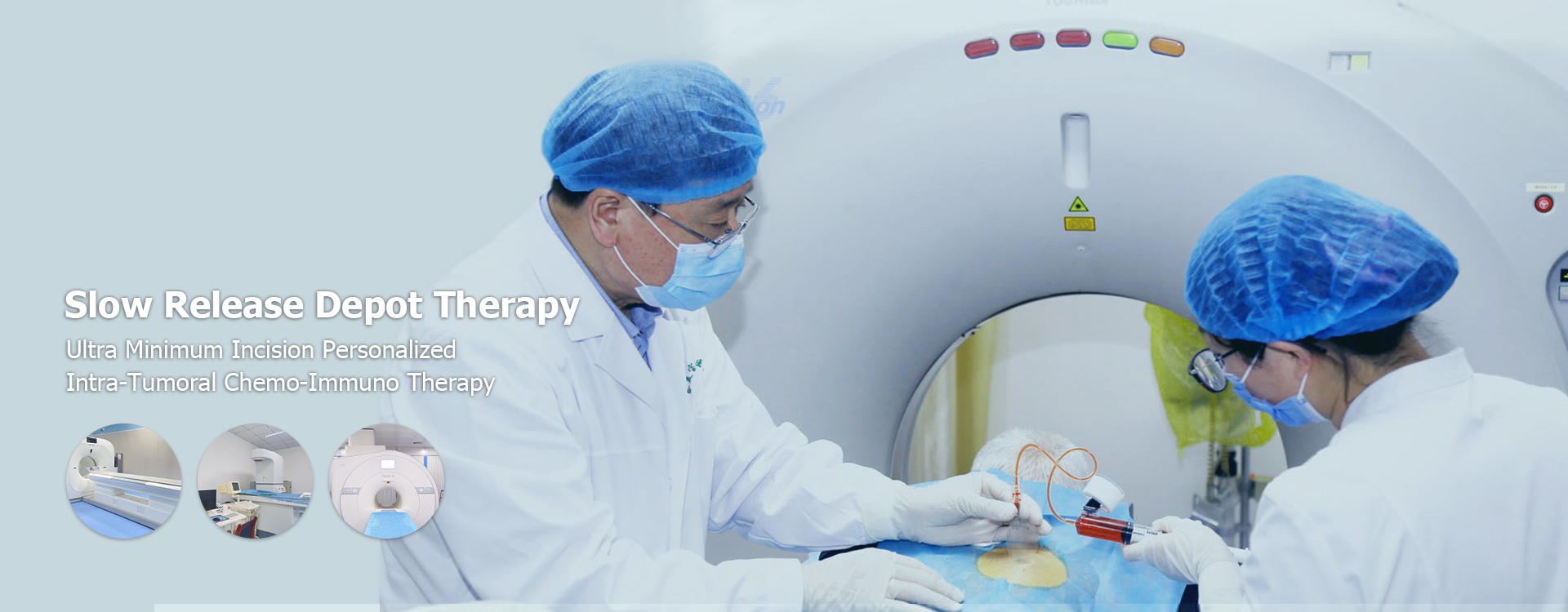
Cielené dodávanie liečiva na rakovinu
Cielené dodávanie liečiva na rakovinu Cieľom je zlepšiť účinnosť liečby a znížiť vedľajšie účinky dodaním terapeutických činidiel špecificky do rakovinových buniek a zároveň minimalizovať vystavenie zdravým tkanivám. Tento prístup využíva rôzne stratégie vrátane nanočastíc, protilátok a peptidov na selektívne zacielenie rakovinových buniek a uvoľňovanie liekov v mieste nádoru. Toto zamerané dodanie zvyšuje koncentráciu liečiva v nádore, čo vedie k zlepšeniu výsledkov a zníženej systémovej toxicite. Introla na cielenú liečbu dodávania liečiva sa v priebehu rokov významne vyvíjala, od tradičnej chemoterapie po sofistikovanejšie prístupy, ako je napríklad sofistikovanejšie prístupy Cielené dodávanie liečiva na rakovinu. Primárny cieľ Cielené dodávanie liečiva na rakovinu je maximalizovať terapeutický účinok liekov a zároveň minimalizovať ich toxické vedľajšie účinky na zdravé bunky. Dosahuje sa to dodaním liekov priamo do miesta nádoru alebo rakovinových buniek, čím sa zabezpečí, že účinok lieku je koncentrovaný tam, kde je to najviac potrebné. Na Inštitút pre výskum rakoviny Shandong Baofa, Odhodlame sa rozvíjať túto oblasť prostredníctvom inovatívneho výskumu a klinických aplikácií. Prečo je cielené dodávanie liečiv dôležité? Tradičná chemoterapia často zahŕňa systémové podávanie liekov, čo znamená, že lieky cirkulujú po celom tele. To môže viesť k významným vedľajším účinkom, ako sú vypadávanie vlasov, nevoľnosť a potlačenie imunitného systému, pretože zdravé bunky sú ovplyvnené aj chemoterapeutickými liekmi. Cielené dodávanie liečiva na rakovinu ponúka niekoľko kľúčových výhod: Znížené vedľajšie účinky: Konkrétne zameraním na rakovinové bunky sa ušetrí zdravé bunky, čo vedie k menším a menej závažným vedľajším účinkom. Zlepšená účinnosť: Vyššie koncentrácie liečiva sa môžu dodávať priamo do miesta nádoru, čím sa zvýši jeho účinnosť. Vylepšené výsledky pacienta: Lepšia účinnosť a znížené vedľajšie účinky môžu viesť k zlepšenej kvalite života a celkovej miere prežitia pacientov s rakovinou. Prekonanie rezistencie na drogy: Cielené dodanie môže pomôcť prekonať mechanizmy rezistencie na lieky, ktoré sa môžu v priebehu času vyvíjať Cielené dodávanie liečiva na rakovinu, každý so svojím jedinečným mechanizmom na selektívne zacielenie na rakovinové bunky: pasívne zacielenie zacielenie sa spolieha na jedinečné charakteristiky nádorového tkaniva, ako sú netesné krvné cievy a zhoršené lymfatické drenáž. Nanočastice sú navrhnuté tak, aby využívali tieto vlastnosti, akumulujú sa prednostne v mikroprostredí nádoru. Toto sa tiež nazýva účinok zvýšenej permeability a retencie (EPR). Aktívne zacielenie zacielenia zahŕňa modifikáciu nosičov liečiva so špecifickými ligandami, ako sú protilátky, peptidy alebo aptaméry, ktoré sa viažu na receptory nadmerne exprimované na rakovinových bunkách. Táto interakcia uľahčuje selektívne absorpciu nosiča liečiva rakovinovými bunkami. Tento prístup zahŕňa: ADC konjugátov protilátok (ADC) pozostávajú z protilátky, ktorá špecificky rozpoznáva antigén spojený s nádorom, ktorý je spojený s silným cytotoxickým liekom. Akonáhle sa ADC viaže na rakovinovú bunku, je internalizovaná a liek sa uvoľňuje vo vnútri bunky, čo vedie k bunkovej smrti. Príkladom je Ado-Trastuzumab emtansín (Kadcyla), ktorý sa zameriava na bunky s rakovinou prsníka pozitívneho na HER2 [1]. Interakčné bunky interakcie receptora Ligand často nadmerne exprimujú určité receptory na svojom povrchu. Pripojením ligandov (molekuly, ktoré sa viažu na tieto receptory) na nosiče liečiv, je možné liek zacieliť priamo na tieto rakovinové bunky. Folátové receptory a receptory transferínu sú bežné ciele [2]. Stimul-responzívne dodávacie systémy reagujúce na stimuli sú navrhnuté tak, aby uvoľňovali lieky iba vtedy, keď sú spustené špecifickými stimulmi prítomnými v mikroprostredí nádoru, ako sú zmeny pH, enzýmová aktivita alebo redoxný potenciál. To zaisťuje, že liek sa uvoľňuje iba na mieste nádoru, čím sa minimalizuje mimo cieľových účinkov. Príklady zahŕňajú použitie lipozómov citlivých na pH, ktoré uvoľňujú svoje užitočné zaťaženie v kyslom prostredí nádorov [3] .Nanočastice v cielenom dodávateľi liečiva Hrajú v Cielené dodávanie liečiva na rakovinu. Tieto malé častice, ktoré sa zvyčajne pohybujú od 1 do 100 nanometrov, môžu byť skonštruované na prepravu liekov a selektívne ich dodávať do rakovinových buniek. Používajú sa rôzne typy nanočastíc, každý s vlastnými výhodami: Lipozómy: Sférické vezikuly zložené z lipidových dvojvrstvových dvojvrstiev, lipozómy môžu enkapsulovať hydrofilné aj hydrofóbne lieky. Polymérne nanočastice: Tieto nanočastice vyrobené z biologicky odbúrateľných polymérov ponúkajú kontrolované uvoľňovanie liečiva a zvýšenú stabilitu. Kvantové bodky: Na zobrazovanie a dodávanie liečiva sa môžu použiť poloduktorové nanokryštály s jedinečnými optickými vlastnosťami, kvantové bodky. Uhlíkové nanotrubice: Valcové štruktúry vyrobené z atómov uhlíka, uhlíkové nanotrubice môžu byť funkcionalizované s zacieľujúcimi ligandami a liekmi. Cielené dodávanie liečiva na rakovinu Systémy sa v súčasnosti klinicky využívajú alebo sa vyvíjajú: Doxil/caelyx: Lipozomálny doxorubicín, schválený na liečbu rakoviny vaječníkov, Kaposiho sarkómu a mnohopočetného myelómu [4]. Jeho lipozomálna formulácia znižuje kardiotoxicitu v porovnaní s tradičným doxorubicínom. Abraxane: Paclitaxel viazaný na albumín, ktorý sa používa na liečbu rakoviny prsníka, nemalobunkového karcinómu pľúc a rakoviny pankreasu [5]. Väzba albumínu zvyšuje dodávanie liečiva na miesto nádoru. CHALLENGES A BUDÚCNOSTI SMERIONSWHILE Cielené dodávanie liečiva na rakovinu Je držiteľom veľkého sľubu, zostáva niekoľko výziev: Heterogenita nádoru: Rakovinové bunky v nádore môžu vykazovať rôzne charakteristiky, čo sťažuje efektívne zacielenie všetkých buniek. Rezistencia na drogy: Rakovinové bunky môžu v priebehu času vyvinúť rezistenciu na cielené terapie. Prekážky dodávok: Dosiahnutie miesta nádoru môže byť náročné v dôsledku fyziologických bariér, ako je bariéra krvného mozgu. Zväčšenie a výroba: Vytváranie cielených systémov dodávania liečiv vo veľkom meradle môže byť zložité a nákladné. Výskumné úsilie sa zameriava na: vývoj sofistikovanejších stratégií zacielenia na prekonanie heterogenity nádoru. Kombinácia cielených terapií s inými spôsobmi liečby, ako je imunoterapia. Vytváranie stimulovaných dodávateľských systémov, ktoré sa môžu prispôsobiť meniacemu sa mikroprostredia nádoru. Zlepšenie škálovateľnosti a nákladovej efektívnosti systémov na dodávanie liečiv s výrobou Inštitút pre výskum rakoviny Shandong Baofa, sme aktívne zapojení do výskumu a vývoja nových Cielené dodávanie liečiva na rakovinu systémy. Náš tím vedcov a lekárov sa snaží prekonať vyššie uvedené výzvy a premietnuť sľubné zistenia výskumu do klinických aplikácií. Veríme tomu Cielené dodávanie liečiva na rakovinu je kľúčovou stratégiou na zlepšenie výsledkov liečby rakoviny a zvýšenie kvality života pacientov s rakovinou.Cielené dodávanie liečiva na rakovinu Predstavuje významný pokrok v liečbe rakoviny, ktorý ponúka potenciál na zlepšenie účinnosti a zníženie vedľajších účinkov. Selektívnym zameraním na rakovinové bunky môžu tieto systémy dodávať vyššie koncentrácie liekov priamo do miesta nádoru, čo vedie k lepším výsledkom pre pacientov. Zatiaľ čo výzvy pretrvávajú, pokračujúce výskumné a vývojové úsilie pripravujú cestu pre efektívnejšie a personálnejšie terapie rakoviny.Referencie Národný inštitút pre rakovinu - konjugáty protilátok Zacielenie na receptor folátu na liečbu rakoviny Lipozómy citlivé na pH pre liečbu rakoviny. Európska agentúra pre lieky - Doxil FDA - Abraxane Prescribing Information
Súvisiaci výrobky
Súvisiace výrobky
Najpredávanejší výrobky
Najpredávanejšie výrobky-
 Mark, pacient s metastázou kostí rakoviny prostaty zo Spojených štátov
Mark, pacient s metastázou kostí rakoviny prostaty zo Spojených štátov -
 Nell Smith, pacient s rakovinou hrdla zo Švajčiarska
Nell Smith, pacient s rakovinou hrdla zo Švajčiarska -
 Pat, pacient s rakovinou rekta zo Spojených štátov
Pat, pacient s rakovinou rekta zo Spojených štátov -
 Anthony, pacient s lymfocytárnou rakovinou zo Spojených štátov 24
Anthony, pacient s lymfocytárnou rakovinou zo Spojených štátov 24 -
 Andress, 9-ročný chlapec zo Spojených štátov
Andress, 9-ročný chlapec zo Spojených štátov -
 Slávna americká maliarka Muriel
Slávna americká maliarka Muriel
Súvisiaci prehliadka
Súvisiace vyhľadávanie- Liečba Najlepšie doplnky pre nemocnice na liečbu rakoviny prostaty
- Čína príznaky rakoviny pankreasu
- Liečba v neskorom štádiu liečby rakoviny prostaty
- Čína liečba mozgového nádoru
- Lacné nemocnice na liečbu rakoviny pľúc
- Čína liečba rakoviny prsníka
- Čína nemocnice o liečbe rakoviny prostaty
- Lacné náklady na nádor pečene
- China Pi rads 4 náklady na liečbu rakoviny prostaty
- Čína rakovina v žlčníku vo svojom okolí